Как найти анод и катод в гальваническом элементе?
Электрод, на котором происходит окисление, именуется анодом; электрод, на котором происходит восстановление, именуется катодом. Гальванический элемент принято записывать так, дабы анод находился слева.
Как найти анод и катод диодика?
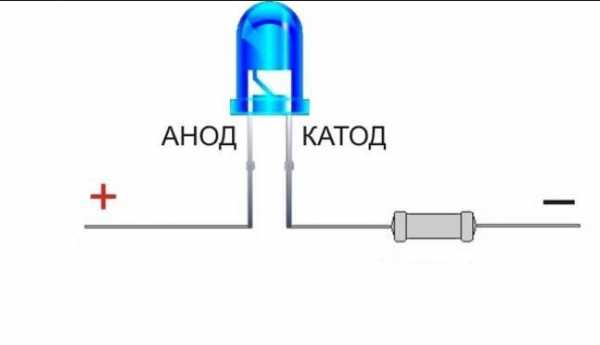
Зрительное различие выводов анода и катода
Новый светодиод, обычно, имеет два вывода (ножки), один из которых мало длиннее другого. Длиннющий вывод – это анод. Его подключают к плюсу источника питания. Маленький вывод – это катод, который соединяют с минусом либо общим проводом.
Как заряжен анод и катод?
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также именуется катодом, но при электролизе он заряжен негативно, а анод — положительно.
Как уяснить анод и катод?
«Катод – отрицательный электрод, анод – положительный. А уяснить это проще всего, если посчитать буковкы в словах. В катоде столько же букв, сколько в слове «минус», а в аноде соответственно столько же, сколько в термине «плюс».
Что происходит в гальваническом элементе?
Гальвани́ческий элеме́нт — хим источник электрического тока, основанный на содействии 2-ух металлов и/либо их оксидов в электролите, приводящем к появлению в замкнутой цепи электрического тока. … Переход хим энергии в электрическую энергию происходит в гальванических элементах.
Читайте также Как проверить работу диодика?
Какой электрод в гальваническом элементе именуется катодом?
протекает самопроизвольно. Электрод, на котором идет процесс окисления, именуется анодом. Электрод, на котором идет процесс восстановления, именуется катодом. В данном случае химическая цепь будет называться электролитической ячейкой, и в ней будет протекать электролиз.
Как найти в какую сторону пропускает диодик?
Поверните ручку на мультиметре в положение для проверки диодика. Приставьте положительный щуп мультиметра к одному концу диодика, а отрицательный — к другому. Если светодиод зажгется, означает, положительный щуп касается положительного конца (анода), а отрицательный щуп — отрицательного (катода).
Как найти полярность диодика по маркировке?
Самый обычный и надёжный метод определения полярности – внедрение измерительного устройства типа «мультиметр», включённого в режим «Прозвонка». При измерении всегда необходимо держать в голове, что на шнур в изоляции красного цвета от интегрированной батарейки подаётся плюс, а на шнур в чёрной изоляции – минус.
Как выяснить где у диодика плюс а где минус?
Дабы этого не случилось, необходимо соблюдать полярность светодиода. Светодиод на схеме обозначается треугольником в кружке с поперечной чертой – это катод, который имеет символ «-» (минус). С обратной стороны находится анод, имеющий символ «+» (плюс).
Что такое катод и анод в физике?
Анод – электрод на котором наблюдается окислительная реакция, другими словами он отдаёт электроны. Электрод, на котором происходит окислительная реакция – именуется восстановителем. Катод – электрод на котором протекает восстановительная реакция, другими словами он воспринимает электроны.
Что такое катод и анод?
Символ анода и катода
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление.
Что идет к аноду?
Катодом при электролизе именуется отрицательный электрод, анодом — положительный. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Читайте также Как замерить ампераж мультиметром на аккуме?
Как именуется отрицательный электрод?
При работе электролизера (к примеру, при рафинировании меди) наружный источник тока обеспечивает на одном из электродов излишек электронов (отрицательный заряд), тут происходит восстановление металла, это катод. На другом электроде обеспечивается недочет электронов и окисление металла, это анод.
Определяем полярность диодика: катод и анод – это минус либо плюс
Для корректной работы полупроводниковых устройств, работающих в цепях с неизменным током, электроды радиоэлементов нужно подключать с учетом их полярности. Неверное подключение может привести к выходу из строя радиоэлемента или к отказу в работе электронного устройства. С целью избегания ошибок электроды таких деталей получили особое название – анод и катод.
Нередко эти электроды обозначаются на схемах надлежащими знаками «+» либо «–», или определяются по схематическому изображению радиоэлемента. На корпусах деталей время от времени проставляется точка либо другая метка, позволяющая найти направление тока на определенном электроде. Время от времени полярность выводов приходится определять по особым таблицам либо при помощи измерительного устройства.
Понятие анода и катода
Для наилучшего осознания определений дадим определения этих понятий.
Под данным термином будем иметь в виду электрод, по которому электрический ток втекает в разглядываемый устройство. При всем этом предполагается, что электрический ток появляется потоком положительных зарядов. В реальности, по железным проводникам передвигаются электроны (носители отрицательных зарядов), которые движутся в сторону положительного полюса источника электрического тока.
Проще говоря, положительным электродом будем считать анод, а отрицательным электродом – катод. При подключении радиоэлементов следует соблюдать их полярность, руководствуясь обозначениями на схемах.
Читайте также: Преобразователь напряжения 12 220 на мультивибраторе
Катод
Это электрод, по которому электрический ток вытекает с устройства (предполагается конвенциальное осознание тока, в виде потока положительных зарядов). Таким макаром, если к аноду подключается провод с положительным потенциалом, то к катоду – клеммы с отрицательными потенциалами.
Вышеуказанные определения используются по отношению к гальваническим элементам. В гальванике анод – это электрод, на поверхности которого проходит реакция окисления металла. Наименования электродов встречаются:
- в химии;
- физике;
- электротехнике;
- радиоэлектронике.
При монтаже радиодеталей очень принципиально не спутать электроды. Для этого следует знать, как найти их предназначение.
Как найти, где анод, а где катод?
При определении катода и анода нужно прежде всего ориентироваться на направление тока, а не на полярность источника питания. Невзирая на то, что эти понятия плотно сплетены с полярностью тока, они больше обоснованы направлениями векторов электричества.
К примеру, в аккумах, при перезарядке, происходит изменение ролей катода и анода. Это связано с тем, что во время зарядки меняется направление электрического тока. Электрод, выполнявший роль электрода при работе аккума в режиме источника питания во время зарядки делает функции катода и напротив – катод преобразуется в анод.
На рис. 1, изображено процесс электролиза, при котором происходит перемещение анионов (отрицательно заряженных ионов) и катионов (положительных ионов). Анионы устремляются к аноду, а положительные катионы – в сторону катода.
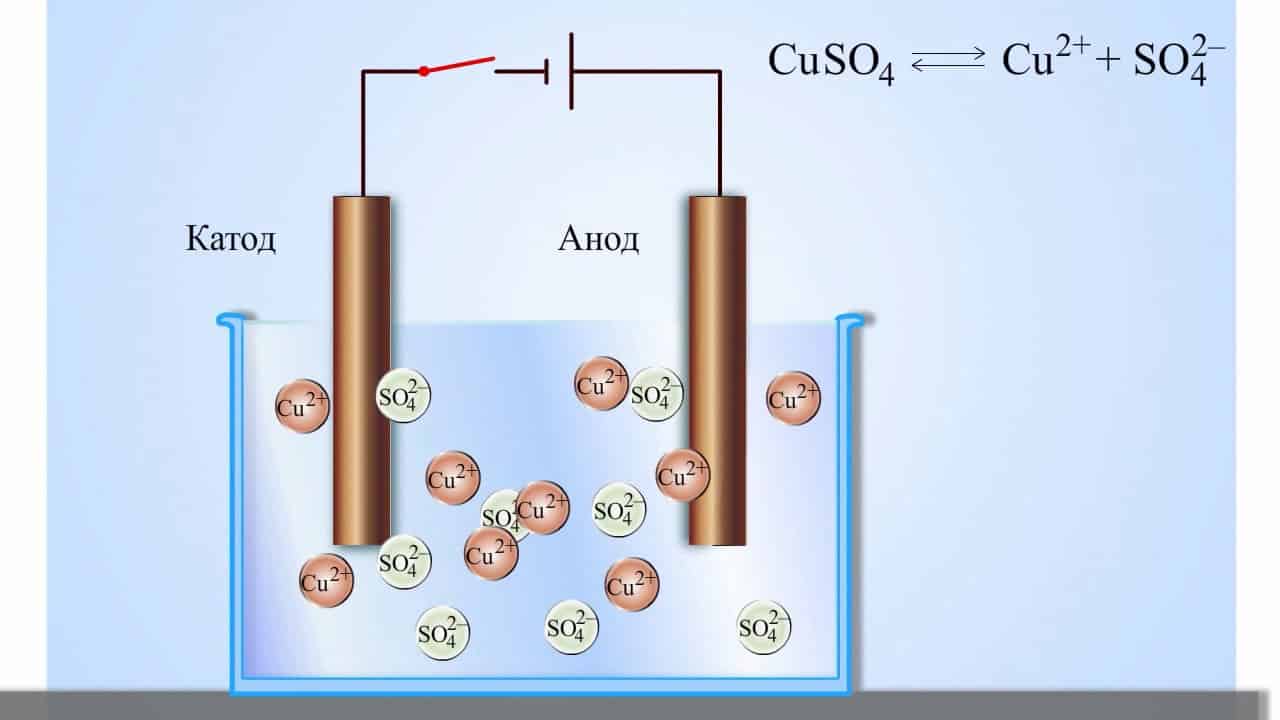
Рис. 1. Электролиз
При электролизе передвигаются носители зарядов различных символов, но, по определению, анодом является тот электрод, в который втекает ток. На рисунке анод подсоединён к положительному полюсу источника тока, а означает, ток условно втекает в этот электрод.
Направьте внимание на набросок 2, где изображена схема гальванического элемента.
Рис. 2. Гальванический элемент
Плюсовой вывод источника тока является катодом, а не анодом, как можно было бы ждать. При внимательном исследовании механизма работы гальванического элемента можно осознать, почему анод является отрицательным полюсом.
Направьте внимание на набросок строения гальванического источника тока. Стрелки (вверху) указывают направление движения электронов, но направлением тока условно принято считать перемещение от плюса к минусу. Другими словами, при замыкании цепи, ток заходит конкретно в отрицательный полюс, который и является анодом, на котором происходит реакция окисления. По другому говоря, ток от положительного электрода через нагрузку попадает на анод, являющийся отрицательным полюсом гальванического элемента. При вдумчивом подходе все стает на свои места.
При определении позиций анода и катода в радиоэлектронных элементах пользуются справочными материалами.
На предназначение электродов показывает:
- форма корпуса (рис. 3);
- длина выводов (для светодиодов) (рис. 4);
- метки на корпусах устройств либо знака анода;
- разная толщина выводов диодика.
Читайте также: Что собой представляет первичная обмотка трансформатора?
Рис. 4. Электроды светодиода
Определение предназначений выводов у полупроводниковых диодов можно найти при помощи измерительных устройств. К примеру, все типы диодов (не считая стабилитронов) проводят ток исключительно в одном направлении. Если вы подключили тестер либо омметр к диодику, и он показал малозначительное сопротивление, то к положительному щупу устройства подключен анод, а к отрицательному – катод.
Если известен тип проводимости транзистора, то при помощи такого же тестера можно найти выводы эмиттера и коллектора. Между ними сопротивление нескончаемо велико (тока нет), а между базой и каждым из них проводимость будет (исключительно в одну сторону, как у диодика). Зная тип проводимости, по аналогии с диодиком, можно найти: где анод, а где катод, а означает найти выводы коллектора либо эмиттера (см. рис. 5).
Рис. 5. Транзистор на схемах и его электроды
Что касается вакуумных диодов, то их нереально проверить методом измерения обыкновенными устройствами. Потому их выводы размещены таким макаром, дабы исключить ошибки при подключении. В электронных лампах выводы точно совпадают с расположением контактов гнезда, созданного для этого радиоэлемента.
Что такое диодик
Диодиками именуют электронные элементы, сопротивление которых изменяется зависимо от направления тока. Если ток подается в одну сторону (плюс на плюс), он проходит просто (диодик открыт) благодаря низкому сопротивлению. При изменении направления электротока (минус на плюс) диодик запирается, сопротивление неоднократно возрастает, пропадает мощность, элемент греется. Есть полупроводниковые элементы, которые заблокируют ток до критичного значения, позже открываются. Их именуют симисторами.
Анод и катод: где плюс, а где минус?
Из произнесенного выше следует, что ток всегда течет в направлении от анода к катоду. Вывод один – на анод поступает плюс, а катод подсоединяется к минусу. Придерживаясь этого правила можно безошибочно найти, где плюс, а где минус.
Вот так можно уяснить:)
В гальванотехнике на катоде происходит реакция восстановления. Другими словами положительные ионы из раствора оседают на катоде. По этому признаку определяем символ минус.
Как найти катод и анод радиодеталей мы разглядели выше. Если есть схема устройства то по ней достаточно просто можно указать направление тока, и, соответственно, предназначение электродов. При отсутствии схемы пользуйтесь признаками и метками на корпусах деталей.
Примечание: по отношению к стабилитрону неправильно использовать термин катод и анод, так как он проводит ток в различных направлениях.
Раздельно заострю ваше внимание на элементах питания. Обычно «+» указывается на гальванических устройствах, а на аккумах нередко маркируются обе клеммы. В аккумах авто типа плюсовую клемму делают толще. По этому признаку также можно найти полярность полюсов.
В качестве выводов см. набросок 6.
Цифрами обозначено:
- 1– анод;
- 2 – электролит;
- 3 – катод;
- 4 – источник тока.
Почему существует неурядица?
Специально, дабы облегчить обучение и практическое использование, было решено, что диодные элементы наименования выводов не будут поменять зависимо от собственной схемы включения, и они будут «прикреплены» к физическим выводам. Но это не относится к аккумам. Так, у полупроводниковых диодов всё находится в зависимости от типа проводимости кристалла. В электронных лампах этот вопрос привязан к электроду, который эмитирует электроны в месте расположения нити накала. Естественно, здесь есть определённые аспекты: так, через такие полупроводниковые приборы, как супрессор и стабилитрон, может малость протекать оборотный ток, но тут существует специфичность, очевидно выходящая за рамки статьи.
Читайте также: Как верно избрать провода по их сечению и мощности
Использование
Электроды в качестве анода и катода более нередко используются:
- в электрохимии;
- вакуумных электронных устройствах;
- полупроводниковых элементах.
Разглядим в общих чертах сферы использования анодов и катодов.
В электрохимии
В данной сфере анод и катод являются главными понятиями, в процессе прохождения химических реакций, применяемых в главном для восстановления металлов. Такие реакции именуют электролизом. Внедрение процессов электролиза позволяет получать незапятнанные металлы, так как на катоде образуются атомы только того металла, положительные ионы которого содержатся в растворе электролита.
Способом электролиза наносят очень тонкое цинковое покрытие железных листов и деталей хоть какой конфигурации. Гальваническое покрытие отлично защищает металл от коррозии.
В вакуумных электронных устройствах
Примером вакуумных устройств служат радиоэлектронные лампы, электронно-лучевые трубки, кинескопы телевизоров. Они работают по одному и тому же принципу: Нагретый катод испускает электроны, которые устремляются к аноду с высочайшим положительным электрическим потенциалом.
Образование электронов на раскаленном электроде именуется термоэмиссией, а электрический ток, возникающий между катодом и анодом, именуется термоэмиссионным. Ценность таких устройств в том, что они проводят ток исключительно в одном направлении – от катода к аноду.
Добавление сетки между электродами позволяет регулировать характеристики тока в широких границах, методом конфигурации напряжения на сетке. Такие вакуумные лампы применяются в качестве усилителей сигналов. В данное время вакуумные приборы применяются достаточно изредка, так как их с фуррором подменяют маленькие полупроводниковые диоды и транзисторы, нередко выполненные на монокристалле в виде микросхемы.
В полупроводниковых устройствах
Электронные детали на базе полупроводников ценятся малым потреблением тока и маленькими размерами. Они практически вытеснили вакуумные лампы из потребления. Выводы полупроводниковых устройств обычно именуют анодами и катодами.
При всех плюсах полупроводников, у этих устройств есть недочет – они «шумят». В усилителях большой мощности эти шумы становятся видными. В высококачественной усилительной аппаратуре как и раньше используются вакуумные лампы.
Электронно-лучевые кинескопы в современных телеках вытесняются экранами с LED подсветкой. Они более экономны, отлично передают палитру цветов, позволяют выполнить приемник практически плоским.
Предназначение диодика
Полупроводниковые диодные элементы находятся фактически во всех бытовых электроприёмниках. Светодиоды применяются в производстве осветительных устройств и LED-телевизоров.
Полупроводниковые диоды классифицируются по:
- материалу кристалла (кремний, селен, фосфид индия, германий);
- размерам (микросплавные, точечные, плоские);
- технологии производства p-n перехода (диффузионные, сплавные, эпитаксиальные);
- частоте (низкочастотные, высокочастотные, сверхвысокочастотные, импульсивные);
- сфере применения (выпрямительные и особые).
Диоды-выпрямители созданы для преобразования переменного напряжения в неизменное. В схему инсталлируются в виде диодного моста, который можно применять в радиоаппаратуре, блоке питания, зарядном устройстве.
Внимание! Продаются готовые диодные мосты (диодные сборки) в виде маленьких коробочек с 4-мя ножками.
Выпрямители делятся на:
- слаботочные (до 0,3 ампер);
- средней мощности (0,3-10 ампер);
- силовые (10-100 000 А, до 6 кВ).
Полупроводниковые особые диодные элементы:
- варикапы (емкостные диоды);
- тиристоры (с дополнительным выводом для переключения в открытое состояние);
- симисторы (ток пропускают в 2-х направлениях);
- стабилитроны (стабилизируют напряжение от 2 вольт в состоянии пробоя, отдельный вид стабиисторы (нормисторы) для напряжения 0,7-2 вольт);
- диоды Шоттки (для низковольтных схем в паре со стабилитроном);
- туннельные диодные элементы (с низким отрицательным сопротивлением);
- динисторы (не содержат управляющих электродов, устанавливаются в переключатели);
- магнитодиоды (вольт-амперные свойства изменяются в магнитном поле, устанавливаются в датчики движения, контрольные приборы);
- фотодиоды (конвертируют энергию света в электрическую);
- светодиоды (превращают электрическую энергию в свет).
Справка! Светодиоды, излучающие инфракрасный свет, именуются инфракрасными. Их устанавливают в камеры видеонаблюдения, беспроводные системы связи, оборудование для дистанционного управления.
Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — хим реакция, происходящая при прохождении неизменного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен негативно), и отрецательных ионов (анионов) к аноду (заряжен положительно).
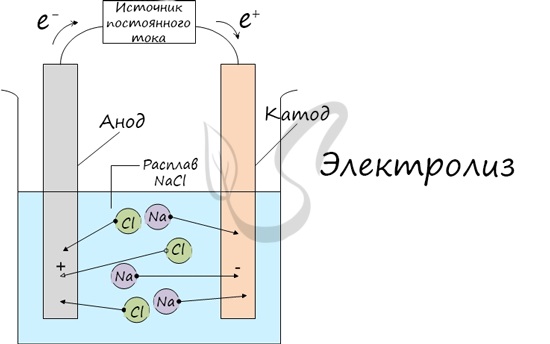
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Тут и происходит хим реакция. Дабы удачно решать задания по данной теме и писать реакции, нужно делить процессы на катоде и аноде. Конкретно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Дабы установить, какая реакция идет на катоде, сначала, необходимо обусловиться с активностью металла: его положением в химическом ряду напряжений металлов.
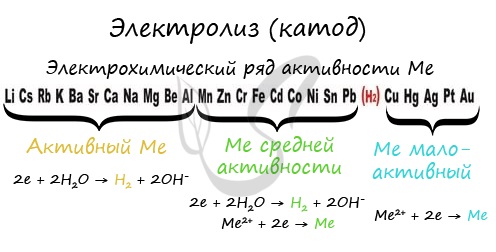
Если на катоде появился активный металл (Li, Na, K) то заместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, заместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (к примеру при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — негативно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .

При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют надлежащие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, потому и является исключением.
Анионы органических кислот окисляются особенным образом: радикал, примыкающий к карбоксильной группе, умножается, а сама карбоксильная группа (COO) преобразуется в углекислый газ — CO2.
Примеры решения
В процессе тренировки для вас могут попадаться металлы, которые пропущены в ряду активности. На шаге обучения вы сможете воспользоваться расширенным вблизи активности металлов.
Сейчас вы точно будете знать, что выделяется на катоде 
Итак, потренируемся. Выясним, что появляется на катоде и аноде при электролизе смесей AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
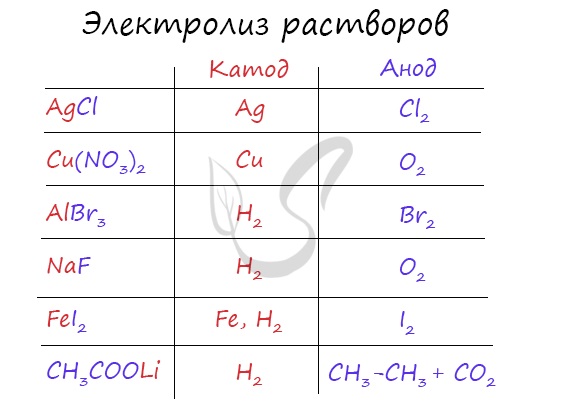
Время от времени в заданиях нужна записать реакцию электролиза. Сообщаю: если вы осознаете, что появляется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, к примеру, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют конкретно запись "NaOH", не подвергая его предстоящему электролизу)
Натрий — активный металл, потому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем вынудить натрий улетучиться безо всяких следов  Натрий вступает в реакцию с водой, появляется NaOH.
Натрий вступает в реакцию с водой, появляется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, потому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, потому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и преобразуется в сероватую кислоту.
Электролиз расплавов
Все, что мы обсуждали ранее момента, касалось электролиза смесей, где растворителем является вода.
Перед промышленной химией стоит принципиальная задачка — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно просто получать способом электролиза смесей.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их смесей они не выделяются на катоде в чистом виде, заместо них восстанавливаются молекулы воды и выделяется водород. Здесь нам как раз понадобятся расплавы, которые не содержат воды.
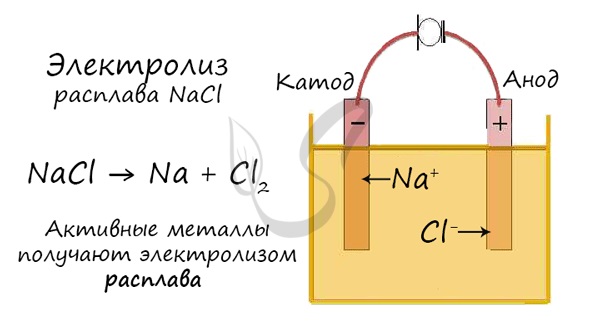
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его умственной собственностью. Копирование, распространение (в том числе методом копирования на другие веб-сайты и ресурсы в Вебе) либо хоть какое другое внедрение инфы и объектов без подготовительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их применения, обратитесь, пожалуйста, к Беллевичу Юрию.